Karbon Dioksit ve Karbon Monoksit
Karbon ya da karbon içeren bileşikler (organik bileşikler) bol havalı ortamda yandığında, karbon dioksit gazı oluşur. Eğer ortamdaki hava yetersiz ise, yani karbonun hepsini karbon dioksite çevirmeye yetecek kadar oksijen, yoksa, zehirli bir gaz olan karbon monoksit oluşur.
Karbon Dioksit
Karbon dioksit, kokusu ve rengi olmayan, suda orta derecede ayrışan ve yoğunluğu havanın yarısına eşit olan bir gazdır. 100 birim hava içinde 6 birimden fazla bulunduğunda karbon dioksit zehir etkisi gösterir; ama öte yandan Dünya’nın atmosferinde bulunan az miktarda karbon dioksit, canlılar için çok gerekli bir maddedir.
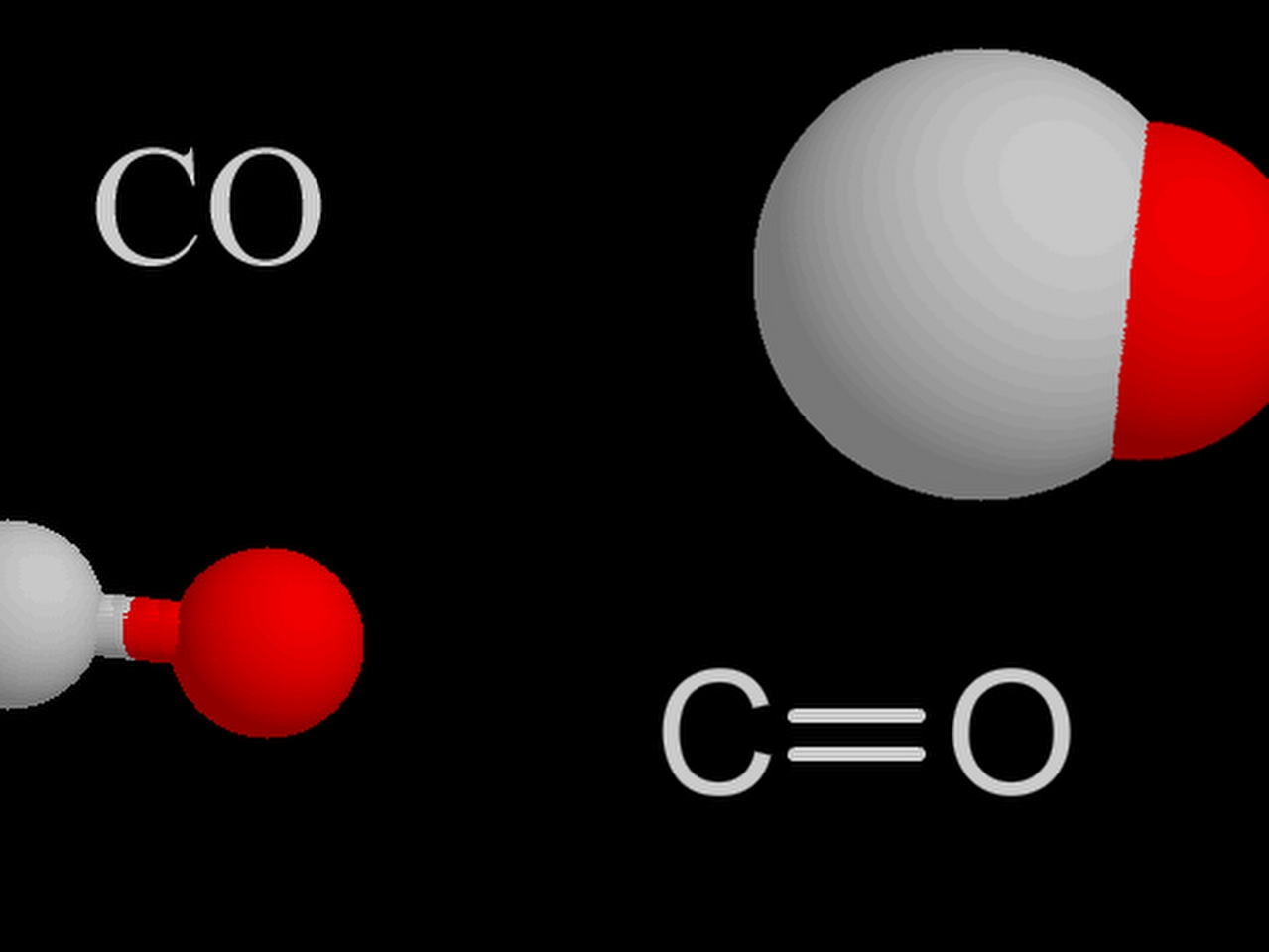
Karbon dioksiti ilk olarak 1630’da HollandalI kimya bilgini Jan Baptist van Helmont buldu. Karbon dioksitin her molekülünde, bir karbon atomu ile iki oksijen atomu vardır. Bu olguyu da 1783’te Fransız kimyacı Antoine Lavoisier saptadı. Karbon dioksitin kimyasal formülü CO2 biçimindedir.
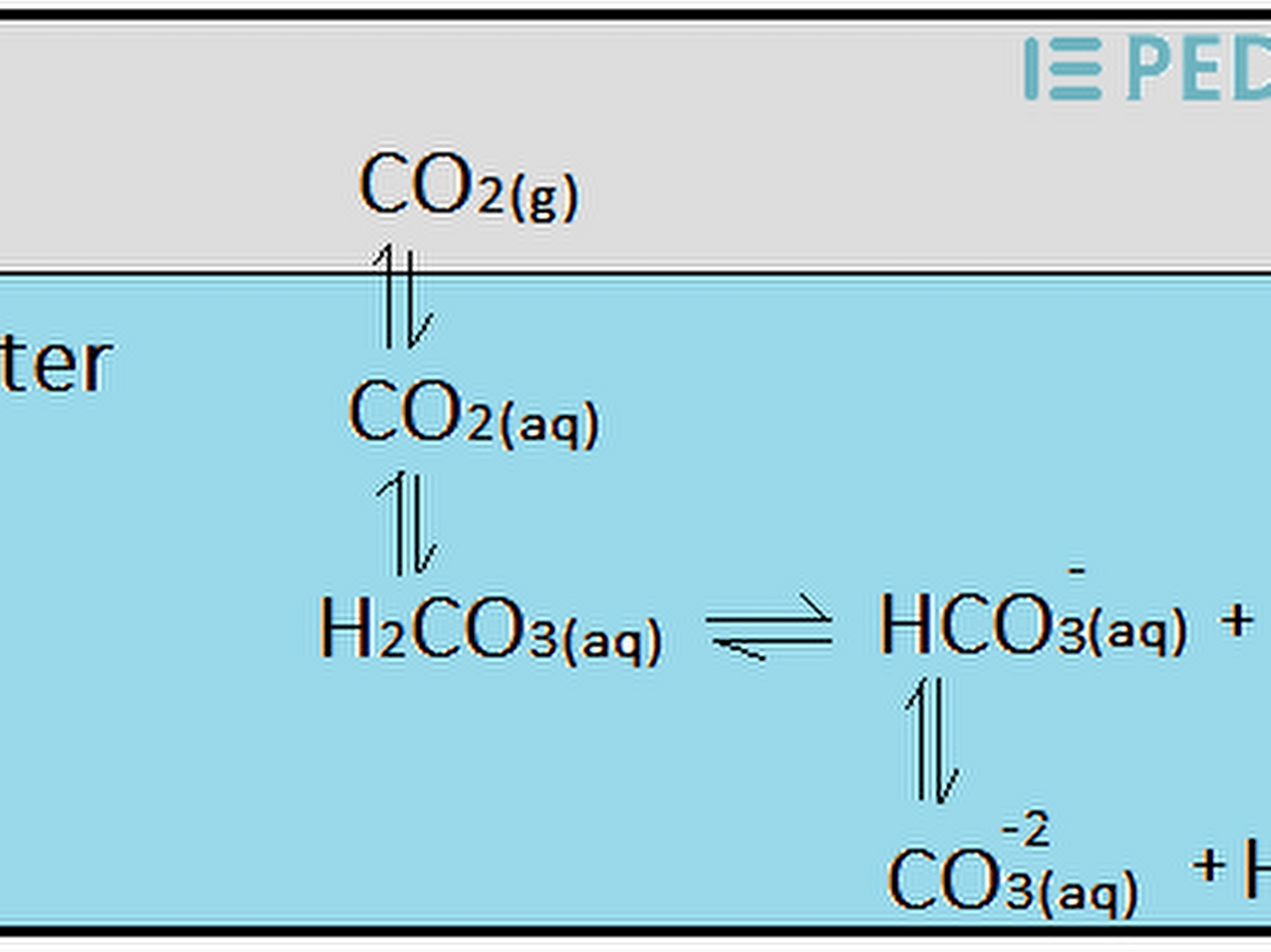
Karbon dioksitin havadaki oranı çok düşüktür (10.000 birimde 3 birim), ama gene de bitkiler ve hayvanlar için yaşamsal bir öneme sahiptir. Karbon dioksitin havadaki bu yüzdesi, bir dizi doğal sürecin sayesinde sabit kalır; bu süreçler dizisine karbon ya da karbon dioksit çevrimi denir. Karbon dioksit atmosfere başlıca iki süreç sonunda katılır. Birincisi, bütün canlılar soluk alıp verir; soluk alma sırasında vücuda çekilen oksijen, besinlerin “yakılarak” enerji üretilmesinde kullanılır ve bu yakma sürecinde oluşan karbon dioksit, soluk verme sırasında karışır. Her soluk sırasında vücuda çekilen havadaki karbon dioksit oranı yüzde 0,03, verilen her soluktaki karbon dioksit oranı ise yüzde 4’tür.
İkincisi, kömür, petrol, ağaç gibi organik yakıtların yakılması ve kireç elde etmek için kireçtaşınm kavrulması gibi sanayi işlemleri sırasında havaya büyük miktarda karbon dioksit karışır. Öte yandan atmosferdeki karbon dioksit başlıca iki yolla tüketilir: Fotosentez ve suda (yağmur, ırmaklar ya da denizler) erimedir. Suda yaşayan kabuklu hayvanlar, sudaki erimiş karbon dioksitten yararlanarak kabuklarını oluşturan kalsiyum karbonatı üretirler. Bu hayvanlar öldüklerinde kabukları, denizlerin ya da ırmakların dibine çöker ve sonunda kireçtaşı ve tebeşir gibi tortul kayaçları oluşturur. Feldispat
gibi kay açlar kil, kum ve potasyum karbonata dönüşürken çok büyük miktarda karbon dioksit tüketirler. Kömür, yeraltına gömülen ağaçların ve büyük bitkilerin milyonlarca yıl içinde taşlaşması sonucunda oluşan bir tortul kayaçtır. Bu maddedeki karbon yakıldığında karbon dioksit oluşur ve karbon dioksit gaz halinde atmosfere karışır. Böylece karbon çevrimi tamamlanmış olur.
Güneş ışığının taşıdığı güneş enerjisinin yeşil bitkiler tarafından alınıp kullanılmasına fotosentez denir; bitkiler güneş enerjisi ile atmosferdeki karbon dioksiti birleştirerek şeker üretirler; bu şekerler daha sonra bitkinin gereksinim duyduğu öteki besin maddelerine (yağlar, proteinler gibi) dönüştürülür. Hayvanların varlığı da, doğrudan ya da dolaylı olarak bitkilere bağlıdır. Kısacası, karbon dioksit, tüm canlılar için gerekli bir maddedir.
Karbon dioksitin bir başka önemli özelliği de, Dünya’nm atmosferine dışarıdan giren ısının, atmosferden dışarı kaçandan daha az olmasını sağlamasıdır. Yani karbon dioksit Dünya’nın çevresinde bir ısı kalkanı işlevi görür; bilim adamları buna “sera etkisi” derler. Havadaki karbon dioksit oranı iki katına çıkacak olsaydı, Dünya’nın sıcaklığı ortalama 3°C artar ve kutuplardaki buzlar erimeye başlardı. Öte yandan atmosferdeki karbon dioksit oranı düşecek olsaydı, Dünya’nın sıcaklığı azalır ve kutuplardaki buzlar yayılmaya başlardı. Yani, karbon çevriminin bugünkü dengesi, yaşamın sürmesi açısından çok önemlidir. Örneğin, dünyadaki ormanların çok büyük bir bölümü kesilir ya da yanıp yok olursa, fotosentez sırasında karbon dioksit tüketen bitki miktarı azalacağından, atmosferdeki karbon dioksit oranı çok yükselir. Öte yandan kömür, odun ve öteki yakıtların denetimsiz biçimde yakılması da havadaki karbon dioksit oranını artırır.
Laboratuvarda karbon dioksit elde etmek için kireçtaşı ya da başka bir karbonata seyreltik asit eklenir. Sizin de evinizde yapabileceğiniz bir deney vardır: Sodaya, sirke gibi bir asit damlatırsanız, karbon dioksit köpükleri oluşacaktır.
Herhangi bir maddenin yanabilmesi için oksijene gereksinim vardır. Karbon dioksit, maddenin oksijenle temas etmesini engellediğinden ateşin sönmesine neden olur. İçinde, sıkıştırılarak toz haline getirilmiş soda ve asit bulunan yangın söndürücüleri, püskürtüldüklerinde su ve karbon dioksit köpüğü üretir; bu köpük ateşin üzerini örter, havayla temasını keser ve yanma sürecini engelleyerek yangını söndürür. Karbon dioksit, basınç altında sıkıştırıldığında sıvı hale gelir; yangınları söndürmekte bazen silindirlerin içine doldurulmuş sıvı karbon dioksit de kullanılır. Sıkıştırılmış karbon dioksitten deniz botlarının şişirilmesinde de yararlanılır. Gazla soğutulan nükleer reaktörlerde, reaktör çekirdeğinde oluşan ısı, karbon dioksit aracılığıyla kazanlara aktarılıp elektrik enerjisi üretilir.
Karbon dioksit, gıda ve içecek sanayisinde de kullanılır. Sofra suyu olarak üretilen soda, karbon dioksitin basınç altında suda eritilmesi yoluyla elde edilir. Gazoz gibi alkolsüz içecekler de sodaya çeşitli tatlandırıcı ve renklendirici maddeler eklenerek hazırlanır. Şişelerin ya da kutuların içindeki sıvı bir miktar basınç altındadır. Şişenin ya da kutunun kapağı açılarak basınç azaltıldığında, sıvıdaki karbon dioksit küçük kabarcıklar biçiminde serbest kalır ve eğer şişe ya da kutu açık bırakılırsa içeceğin tadı kaçar. Kabartma tozundaki sodyum bikarbonat pişme sırasında karbon dioksit üretir, bu da ekmek ve keklerin kabarmasını sağlar.
Karbon dioksit normal atmosfer basıncında —78°C’ye kadar soğutulduğunda, “kuru buz” denen beyaz renkli bir katı maddeye dönüşür. Buna kuru buz denmesinin nedeni, ısıtıldığında hiç sıvılaşmadan doğrudan gaz haline geçmesidir. Kuru buzdan soğutucu gaz olarak yararlanılır; kolayca taşınabilir, artık bırakmaz ve ayrıca besin maddelerinden oksijeni uzak tuttuğundan iyi bir koruyucudur.
Karbon dioksit, Güneş sisteminin öteki gezegenlerinin atmosferlerinde de gaz olarak bulunur. Mars’ın atmosferinin yüzde 96,5’i karbon dioksitten oluşur. Venüs’ün sülfürik asit bulutlarıyla dolu yoğun atmosferinin yüzde 96’dan fazlasını da karbon dioksit oluşturur.
Karbon Monoksit
Karbon monoksit, kimyasal formülü CO olan, renksiz ve kokusuz bir gazdır. Karbon dioksitin tersine, yoğunluğu havanın aynısıdır ve insan kanındaki oksijeni taşıyan kırmızı pigmentle geri dönülmez biçimde birleştiğinden son derece zehirlidir. Havada on binde bir oranında bile bulunsa baş ve mide ağrılarına yol açar; binde bir oranına yükseldiğinde ise ölüme neden olur. Organik yakıtların yakıldığı dizel ve benzin motorlarından çıkan egzoz dumanında da bir miktar karbon monoksit gazı vardır. Bu nedenden ötürü, kapalı bir garajda araba çalıştırmak tehlikelidir; ayrıca trafiğin çok yoğun ve sıkışık olduğu Tokyo gibi kentlerde trafik polislerinin görev süresi oldukça kısadır ve polisler görevleri sona erdiğinde derhal özel tüplerden oksijen solurlar.
Karbon monoksit mavi bir alevle yanar ve çevreye çok ısı verir. Sanayide yakıt ve demir cevherinden demir elde edilmesine indirgeyici olarak kullanılır. Sıcak kokkömürünün üzerinden buhar geçirilerek elde edilen “su gazı” , karbon monoksit ve hidrojen karışımından oluşur; su gazı yakıt ya da organik kimyasal maddelerin elde edilmesinde hammadde olarak kullanılır.