Periyotlar Cetveli
Periyodik cetvel ya da periyodik tablo olarak da anılan periyotlar cetveli, bilinen bütün elementlerin artan atom numaraları'na (günümüzde buna bazen proton sayısı da denir) göre sıralandıkları bir listedir. Liste, benzer özellikleri olan elementler bir araya gelecek biçimde düzenlenmiştir.
1869’da Rus kimyacı Dimitriy İvanoviç Mendeleyev, o dönemde bilinen bütün elementleri atom kütlelerinin (buna eskiden atom ağırlığı denirdi) büyüklüğüne göre sıralayarak bir liste hazırladı. Mendeleyev, İngiliz kimyacı John Newlands'ın yaptığı araştırmalardan, benzer kimyasal ve fiziksel özelliklerin listede oldukça düzenli aralıklarla yineleneceğini biliyordu ve cetvelini de benzer özellikleri olan elementler alt alta gelecek biçimde hazırlamıştı. Cetvelinde bazı boşluklar kalmıştı, ama Mendeleyev bu boşlukların ileride bulunacak elementlerle dolacağını tahmin ediyordu; bu tahmininde haklı da çıktı. Öte yandan Alman kimyacı Lothar Meyerde aynı sıralarda benzer buluşlar gerçekleştirdi.
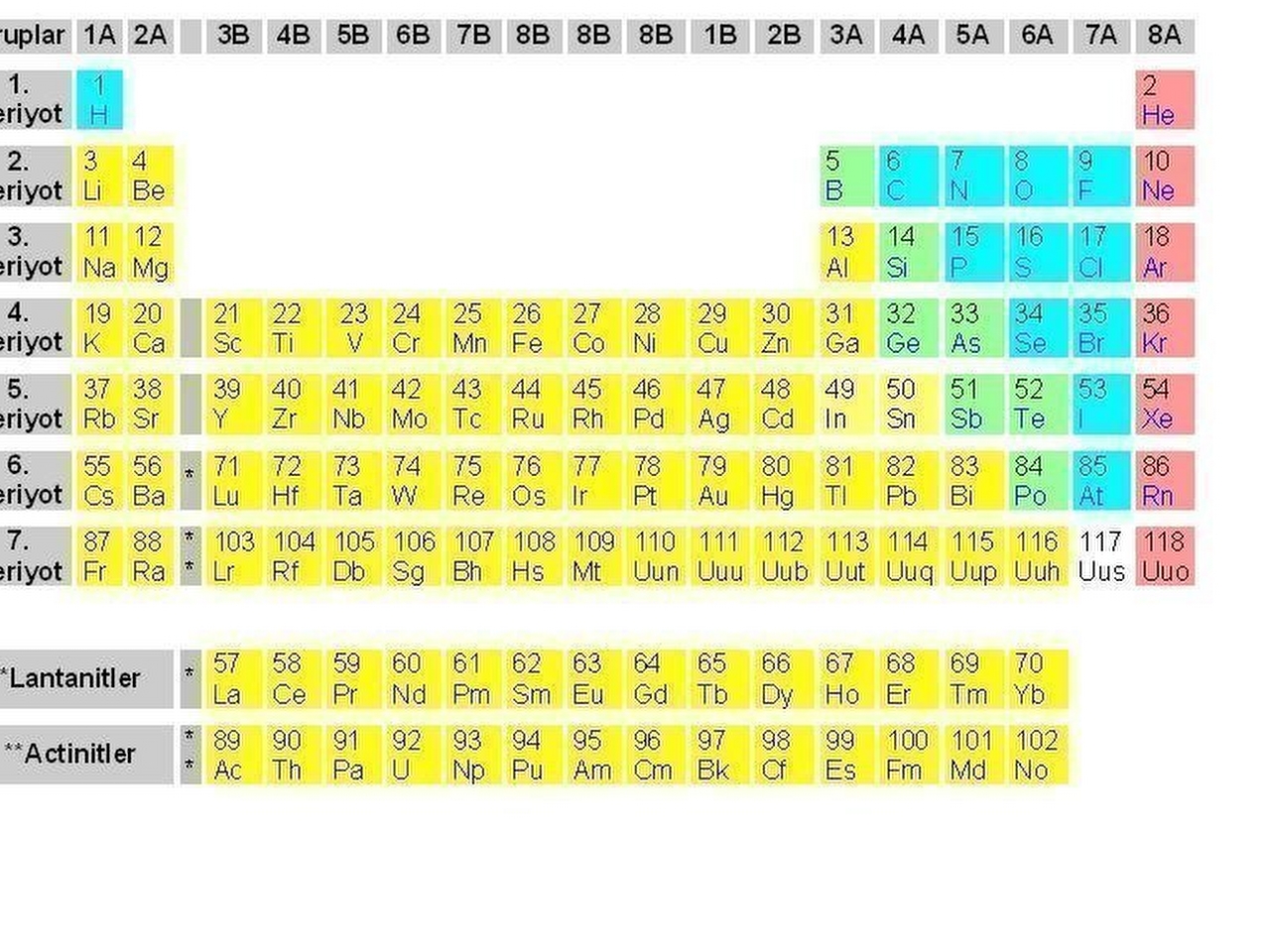
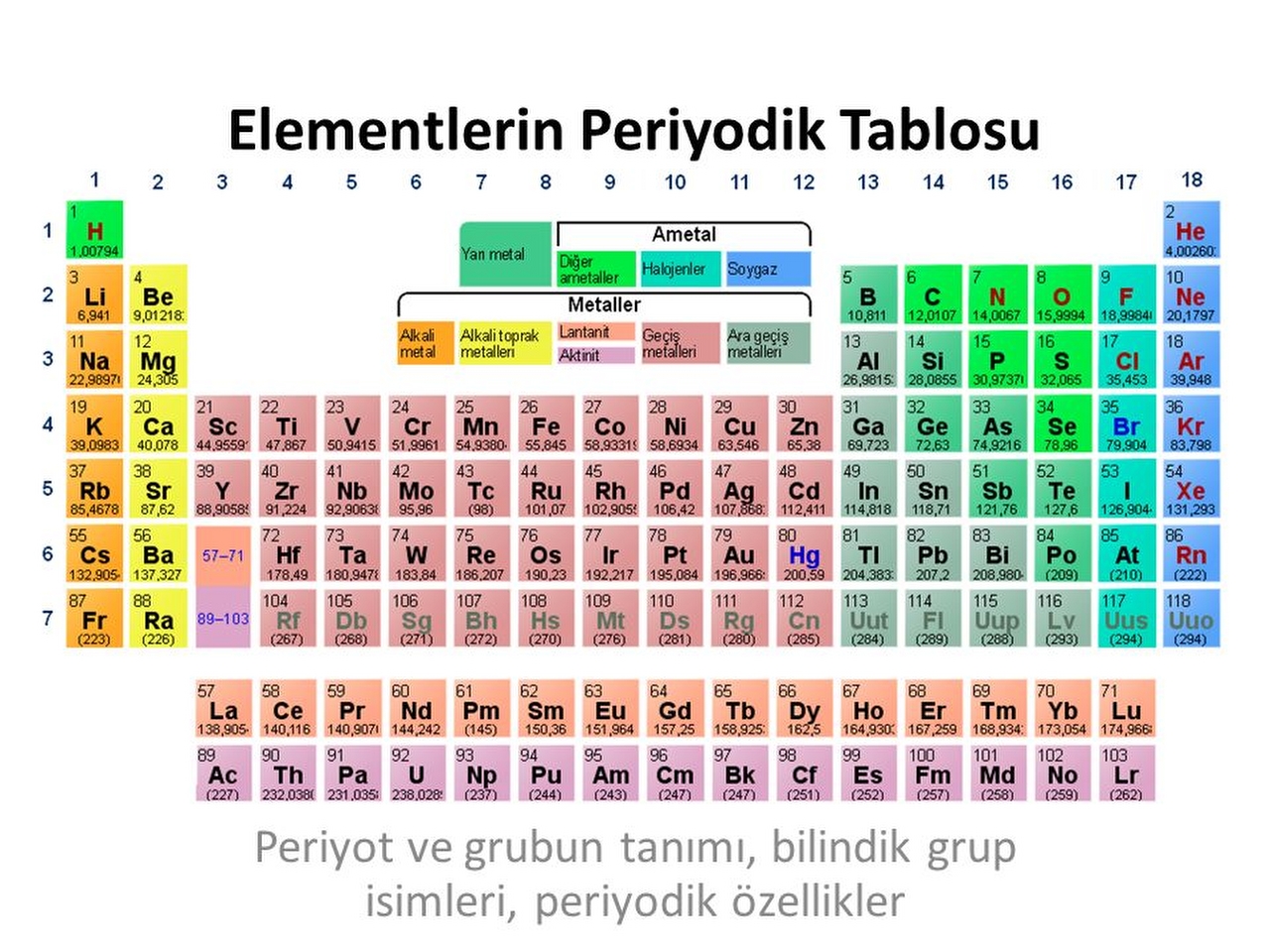
Mendeleyev’in hazırladığı ilk cetvelde 17 sütun vardı; ama cetvel daha sonraları yeniden gözden geçirildi ve sütun sayısı sekize indirildi. O zamandan bu yana yeni elementler bulundukça cetvel birçok kez değişti. Periyotlar cetvelinin en yaygın kullanılan biçimi çizimde gösterilmiştir. Her kareye bir elementin kimyasal simgesi yazılmıştır. Örneğin, berilyum elementi “Be” ile gösterilmiştir (cetvelin sol üst köşesine bakınız). Periyotlar cetvelinin her karesinde, elementin simgesiyle birlikte atom numarası da yer almaktadır. Berilyumun atom numarası 4’tür ve bu, berilyumun çekirdeğinde dört proton olduğunu gösterir. Cetvelde grup denen 18 düşey sütun bulunmaktadır. Aynı gruptaki elementlerin benzer özellikleri vardır, çünkü bu elementlerin en dış elektron kabuklarındaki elektronların yerleşim düzeni birbirinin aynıdır. Bu benzerlikler yatay sıralar halinde; düzenli aralıklarla (periyodik olarak) yinelenir; böyle yedi yatay sıra, yani yedi periyor vardır.
Yatay sıralarda, yani her periyotta soldan sağa doğru gidildikçe atomların elektron sayısı artar. Bu artış genellikle dış kabuktaki elektron sayısında olur. Ama cetvelin orta bloğunda yer alan geçiş elementleri'nde, bu artış dolmamış durumdaki iç kabuklarda olur. Geçiş elementlerinin daha içte kalan iki dizisine cetvelin altında yer verilmiştir. Lantanitler ya da azrak toprak metalleri denen bu dizinin 15 elementi kimyasal olarak birbirine çok benzer. Bu 15 element, doğada yalnızca başka elementlerle oluşturdukları kimyasal bileşikler (karışımlar) halinde bulunur ve bu elementleri bileşiklerden ayırmak çok güçtür. Azrak toprak metallerinin bazılarına doğada çok ender rastlanır; ama bunlardan biri olan seryum (Ce), altın, gümüş ve kalaydan daha boldur. Aktinitler denen öbür dizinin elementleri radyoaktif elementlerdir. Aktinitlerden yalnızca dördü doğada bulunur; bunlardan biri de uranyumdur. Öbürleri ise, laboratuvarda başka elementlerin çekirdeklerinin yüksek enerjili parçacıklarla bombardıman edilmesi sonucunda elde edilir; bu yolla elde edilen aktinitlerin biri de plütonyumdur. Uranyum ve plütonyum atom enerjisi üretiminde kullanılır. Atom numarası 92’den büyük olan elementlere uranyum ötesi elementler denir. Yeni bulunan uranyum ötesi elementler henüz adlandırılmamıştır ve bunlar atom numaralarıyla tanınır (element 104, element 105 gibi). Element 108’in yeri açılmış, ama bu element henüz elde edilememiştir.
Bugün bilinen yalnızca 109 element vardır; buna karşılık bileşik halinde bulunan madde sayısı çok daha fazladır. Bu nedenle, elementler arasındaki bağıntıları gösteren bir cetvelin olması bilim adamlarına büyük yarar sağlar. Örneğin, asal gazların hepsi de zor yoğunlaşır. IA grubundaki alkali metaller, yumuşak, erime noktaları düşük, metal yapılı katılardır.