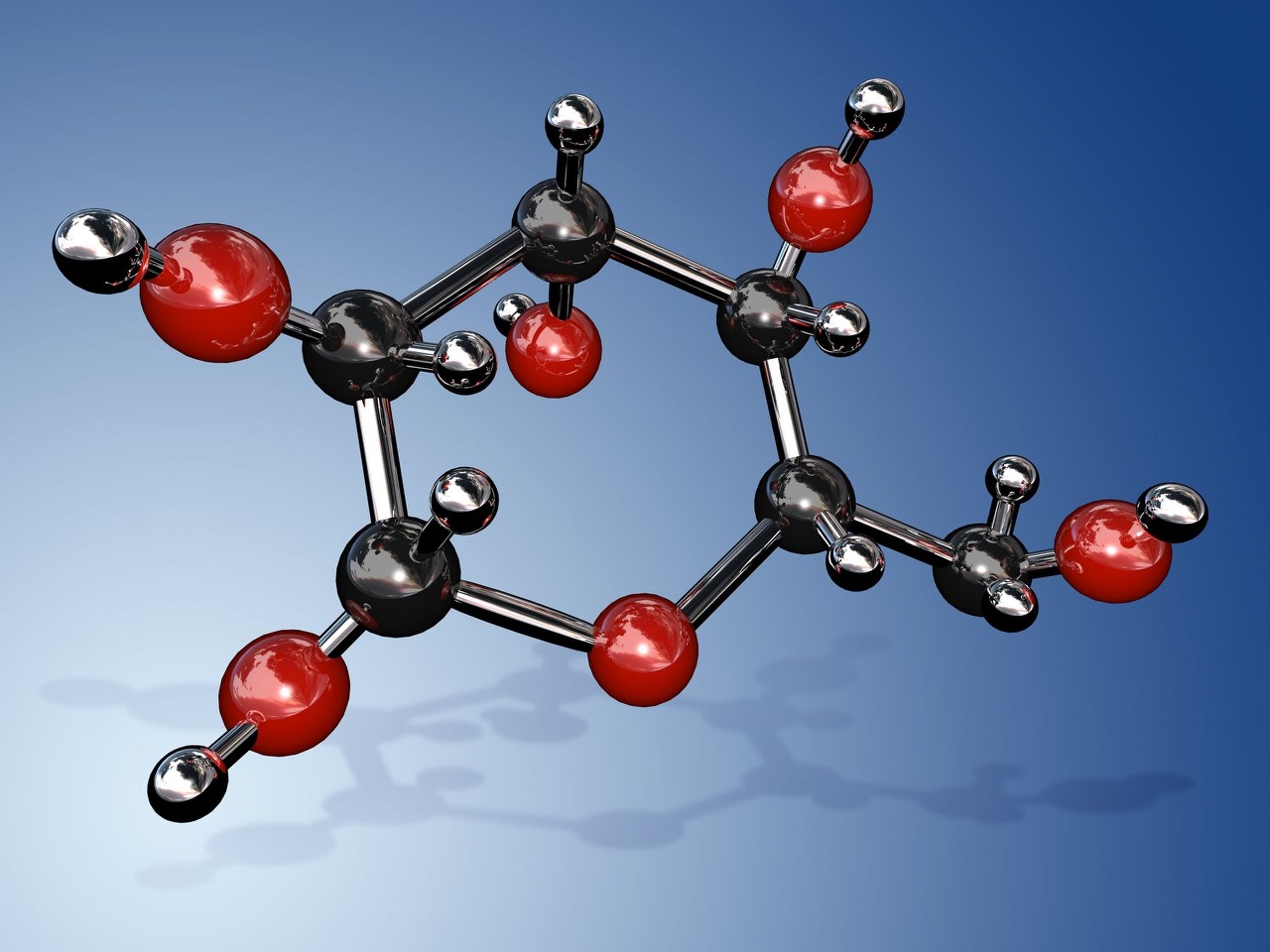
Molekül
Molekül, herhangi bir maddenin, bütün kimyasal özellikleri değişmeksizin aynı kalacak biçimde bölünebileceği en küçük parçasıdır. Moleküller atomlardan oluşur. Herhangi bir elementin molekülü, bir ya da birden çok, ama hepsi aynı tür atomdan oluşur; oysa bir kimyasal bileşiğin molekülünde iki ya da daha çok değişik elementin atomları bulunur. Hidrojen elementinin molekülünde iki hidrojen atomu vardır; bir hidrojen ve oksijen bileşiği olan suyun molekülünde ise, iki hidrojen atomu ile bir oksijen atomu bulunur. Öte yandan daha karmaşık bir bileşik olan ve bitkilere yeşil rengini veren klorofil, beş değişik elementin 136 atomundan oluşan bir moleküle sahiptir.
Kimyasal formülü H2O olan bir su molekülü, ancak hidrojen ve oksijene ayrıştırılarak bölünebilir. Her ikisi de gaz olan hidrojen ve oksijen molekülleri, birbirlerinden olduğu kadar, birleştiklerinde oluşturdukları sudan da çok farklı özelliklere sahiptir.
Herhangi bir maddenin katı, sıvı ya da gaz halinde bulunması, moleküllerinin davranışına bağlıdır. Katilarda moleküller birbirlerine çok yakın, sıkışık biçimde bir arada bulunurlar; bunun sonucunda ortaya çıkan sıkı ve kararlı yapı, katı maddenin biçimini korumasını sağlar. Bilim adamları, katı maddelerin moleküllerindeki atomların yerleşim düzenini saptamışlar ve çok sayıda değişik yerleşim düzeninin bulunduğunu ortaya çıkarmışlardır. Sıvılarda ise moleküllerin konumu sabit değildir ve bunlar birbirlerinin üzerinden kayabilir. Bu nedenle sıvılar, hacimlerinde herhangi bir değişiklik olmaksızın kolayca biçim değiştirebilir. Öte yandan gazlarda moleküller birbirlerinden o kadar uzaktır ki, kapladıkları hacimde serbestçe hareket edebilirler. Bu nedenle de gazlar genleşerek, yani yayılarak bulundukları kabı doldurur. Ayrıca katı ve sıvıların tersine gazlar iyice sıkıştırılarak küçük bir hacme sığdırılabilir. Oksijen molekülleri normal sıcaklıklarda, saniyede yaklaşık 450 metre hızla hareket eder; hidrojen molekülleri ise bunun neredeyse dört katı kadar bir hızla hareket eder. Ama moleküller birbirleriyle çarpıştıklarından fazla uzağa gidemezler.
Bir maddedeki moleküllerin hareketi, o maddenin sıcaklığına bağlıdır. Herhangi bir cisimdeki moleküllerin tüm enerjisi çekilip alınabilseydi, cismin sıcaklığı “mutlak sıfır” a (yaklaşık —273°C) düşer ve moleküller tümüyle hareketsiz duruma gelirdi. Bir madde ne kadar ısıtılırsa molekülleri de o kadar hızlı hareket eder. Isı enerjisi, kinetik enerji denen hareket enerjisine dönüşür.
Katilarda ise moleküller yer değiştirmez ve yalnızca bulundukları yerde titreşebilir. Katiların sıcaklığı ne kadar yükselirse, moleküllerinin titreşimi de o kadar hızlanır. Kızgın bir demirde moleküller o kadar hızlı titreşir ki, demire dokunduğumuzda moleküllerin bu hareketini elimizi yakan bir sıcak biçiminde duyumsayabiliriz. Çaydanlıktaki su kaynadığı zaman, su molekülleri o kadar hızlı hareket etmeye başlar ki, artık sudaki gibi bir arada durmazlar ve birbirlerinden iyice uzaklaşarak gaz haline, yani buhara dönüşürler.
Moleküller aslında çok ufak parçacıklardır; örneğin, ortalama büyüklükteki bir balonu dolduran bir gazda, bütünüyle balon hacmine saçılmış durumda bulunan yaklaşık 80.000.000.000.000.000.000.000 molekül vardır. Canlıların hücrelerinde bulunan pek çok madde, yüz binlerce atomdan yapılı dev moleküllerden oluşur. Bu tür moleküllere makromolekül denir (makro sözcüğü, “büyük” anlamına gelen Eski Yunanca bir sözcüktür). Proteinler, selüloz ve kalıtım maddeleri olan DNA (deoksiribonükleik asit), makromoleküllü organik maddelerdir. Makromoleküller, elektron mikroskopu altında görülebilir.
Günümüzde kimyacıların yapay olarak üretebildikleri maddelerin pek çoğu örneğin plastikler, yapay kauçuklar, silikonlar uzun atom zincirlerinden ya da katmanlarından oluşan ve polimer denen makromoleküllerdir. Böyle bir maddenin özellikleri ve davranışı, atomlarının birbirine bağlanma biçimine bağlıdır. Örneğin polietilen elde etmek için, etilen moleküllerinin zincir biçiminde birbirine bağlanması gerekir.
Bilimsel çalışmalarda çoğu zaman moleküllerin kütlelerinin bilinmesi ve hesaba katılması gerekir; ama moleküller o kadar küçük parçacıklardır ki, bunların kütlesini gram cinsinden ölçmek olanaksızdır. Bu nedenle bilim adamları, bağıl molekül kütlesi denen bir ölçüden yararlanırlar. Eskiden molekül ağırlığı denen bağıl molekül kütlesi, o molekülün kütlesinin bir hidrojen atomunun kütlesinin kaç katı olduğunu gösterirdi. Gerçek bağıl molekül kütlesi değerleri, moleküllerin, bağıl atom kütlesi tam 12 olan karbon-12 izotopuyla (C12) karşılaştırılması yoluyla belirlenir. Buna göre, oksijenin bağıl atom kütlesi (eskiden atom ağırlığı denirdi) 16’dır. Amonyağın (NH3) bağıl molekül kütlesi ise 17’dir, çünkü amonyak molekülü bir azot atomu (bağıl atom kütlesi 14) ile üç hidrojen atomundan (her birinin bağıl atom kütlesi 1) oluşur.
Maddenin moleküllerden oluştuğu düşüncesini ilk olarak İtalyan bilim adamı Amedeo Avogadro (1776-1856) ortaya atmıştır.